Frenkel defect in fluorite - Tribulations
Frenkel defect in fluorite - Tribulations
Avant-propos :
L'article qui suit n'est pas à prendre pour argent comptant, il est le fruit de réflexions et de spéculations qui n'engage que moi. Des investigations supplémentaires doivent être menées afin de corroborer ou non les hypothèses mises en avant dans les lignes qui suivent. En vous souhaitant une bonne lecture !
Rémi BORNET - le 29 août 2018
Photo ci-contre :
Fluorine de la Mine de La Barre, Puy-de-Dôme, France avec impressionnant défaut de Frenkel en sapin - 2,6 x 1,8 x 1,7 cm.
Introduction :
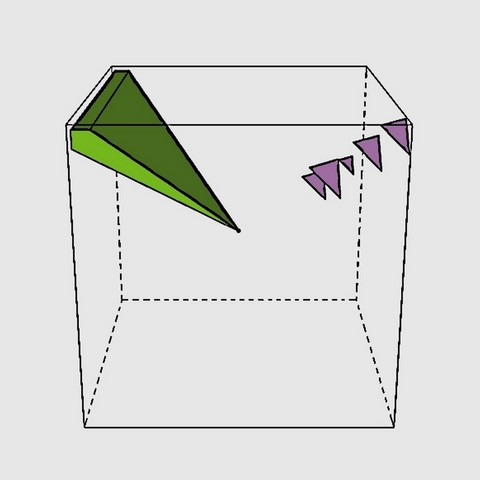
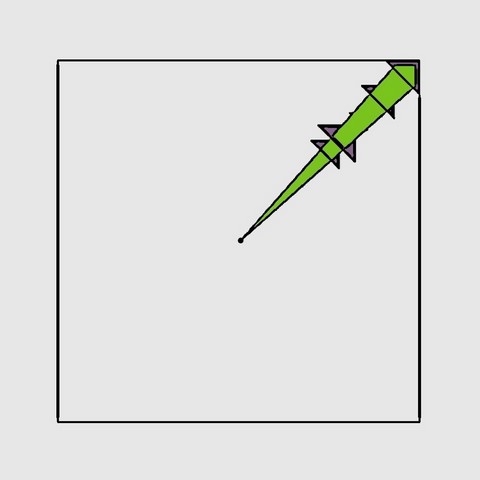
Le "défaut de Frenkel" est le nom généralement donné par les collectionneurs de minéraux à une coloration particulière qui suit la direction d'une grande diagonale du cube (en vert sur le schéma 3D de gauche), dont l'observation la plus spectaculaire se fait perpendiculairement à une face du cube. Nous ne connaissons pas l'origine exacte de cette dénomination, il semblerait qu'elle provienne de la littérature scientifique espagnole, mais sans réelle certitude (Nassau, K. 1980 - Las causas del color. Investigacion y ciencia / Bocamina Volume 2 "Fluorita de Asturia"). Cette coloration est peu fréquente et de couleur verte et n'est visible que selon 2 faces opposées du cube. Le "défaut de Frenkel" est souvent confondu avec la zonation sur (111) qui produit des triangles de couleurs variés perpendiculaire au sommet du cube (en violet sur le schéma 3D de gauche). Ces triangles sont eux visibles à partir des 3 faces adjacentes au sommet du cube. Cependant il faut noter que ces 2 caractéristiques sont très souvent associées et sont à l'origine de couleurs bizarres...
Défaut de Frenkel - Définition scientifique :
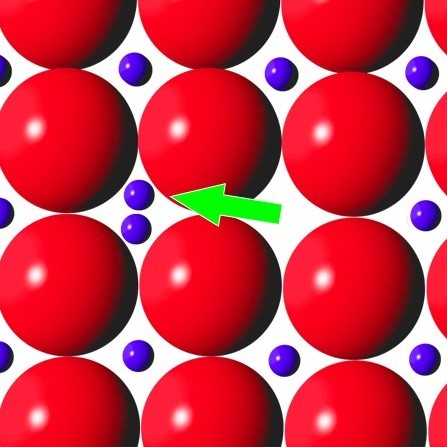
En cristallographie, afin de mieux comprendre l'agencement de la matière à l'échelle atomique on considère des modèles de cristaux parfaits dans lesquels tout est idéal. Chaque atome ainsi à sa place constitue la brique d'une structure cristalline à grande échelle à la géométrie parfaite. Mais il n'y a rien de plus imparfait que la Nature, et en réalité les défauts d'empilement sont fréquents et abondants. Parmi ces défauts, on note celui de Frenkel justement. C'est lorsqu'un atome ou un ion quitte sa position normale pour venir en position interstitielle (voir schéma de droite). Etant donné la différence de taille de l'atome de calcium, 4,6 fois plus gros que celui de fluor, on comprend aisément qu'il n'est pas très compliqué de rajouter du fluor en position interstitielle puisque il y a la place pour 4 ou 5 atomes de fluor sur le site de ce même fluor... (Voir schéma de droite avec dimensions relatives des atomes de calcium en rouge et de fluor en bleu respectées). Cependant si ces défauts ponctuels sont forcément présent au sein d'un cristal de fluorine, à l'échelle atomique ils ne peuvent pas expliquer une coloration visible à l'oeil nu, à moins d'êtres regroupé ou concentré à un endroit précis.
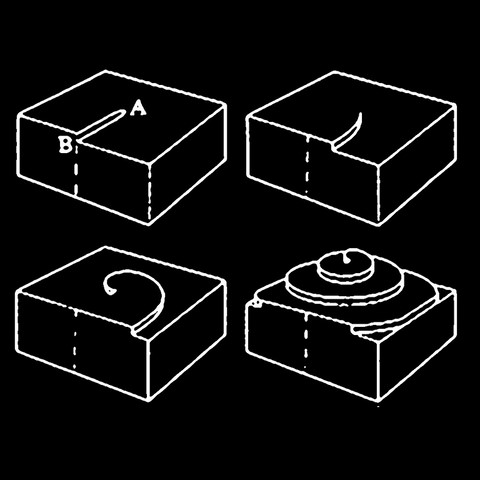
Mode de croissance d'un cube de fluorine
Lorsque l'on observe des cubes de fluorine (tous gisements confondus) et que l'on attache de l'importance aux détails de surfaces des cristaux, on remarque très vite la présence de structures spiralées de formes carrés, rectangulaires ou rondes sur les faces. Ces structures sont soit en bosses soit en creux, ce sont donc soit des figures de croissances soit des figures de dissolution. En réalité ces formes sont liées elles aussi à un défaut cristallin : la dislocation vis. Lors de la croissance d'une face d'un cube de fluorine, il n'est pas rare qu'un petit cristal d'une autre espèce minérale (sulfure, oxyde ou autre...) vienne se coller sur la fluorine qui en deviendra son hôte, on parle in fine tout simplement d'inclusions. Ce minéral étranger va ainsi venir géner la croissance de la fluorine en décalant des couches atomiques et ce décalage va considérablement accéler la croissance du cube. Les atomes vont alors s'empiler rapidemment en suivant une spirale dont le centre est le défaut lui même, de l'intérieur de la face du cube vers l'extérieur. Sur la photo de gauche, une fluorine anglaise maclée on le voit très bien, dans ce cas précis, le défaut d'empilement provient de la macle elle-même et la dislocation tourne autour.
Hypothèses de formation du "Défaut de Frenkel" des fluorines
Lorsque l'on a une ou plusieurs spirales de dislocation sur une face, la dernière partie de la face à grandir est l'extérieur, ou autrement dit l'arête du cube. Maintenant si 2 faces adjacentes du cubes grandissent par dislocation en même temps on se retrouve donc à l'échelle atomique avec une "marche d'escalier" au niveau de d'arête du cube lorsque les dislocations se rejoignent (schéma ci-dessous). L'arête du cube présente alors un défaut de charge électronique très important. Plusieurs hypothèses s'ouvrent alors :
1.- Ce défaut de charge va permettre d'attirer beaucoup plus d'atome de fluor que sur le centre d'une face par exemple. Le site du fluor permettant physiquement d'accueillir plusieurs atomes de fluor, il va être alors saturé. Des atomes de fluor seront alors davantage lacunaires dans l'environnement proche de cette zone afin d'équilibrer la charge électrique à l'échelle du cristal. A l'échelle de l'arête en revanche, on a un grand nombre d'anions en position interstitielle qui expliquerait que cela se traduise à l'oeil nu par une modification de l'absorption de la lumière et donc plus largement une modification de la couleur. L'appelation "défaut de Frenkel" serait alors pertinente.
2.- Ce défaut de charge va permettre d'attirer un ou d'autres anions n'entrant habituellement pas dans le réseau cristallin de la fluorine (terres rares ou autres...). L'appelation "défaut de Frenkel" serait inaproprié, on aurait affaire à une zonation chimique.
Seul une analyse chimique quantitative ponctuelle de cette zone colorée (micro-sonde) pourrait permettre de trancher, en gardant bien sûr à l'esprit que le fluor est un élément qui posent des problèmes d'analyses via cette méthode puisqu'il a tendance à se diffuser...
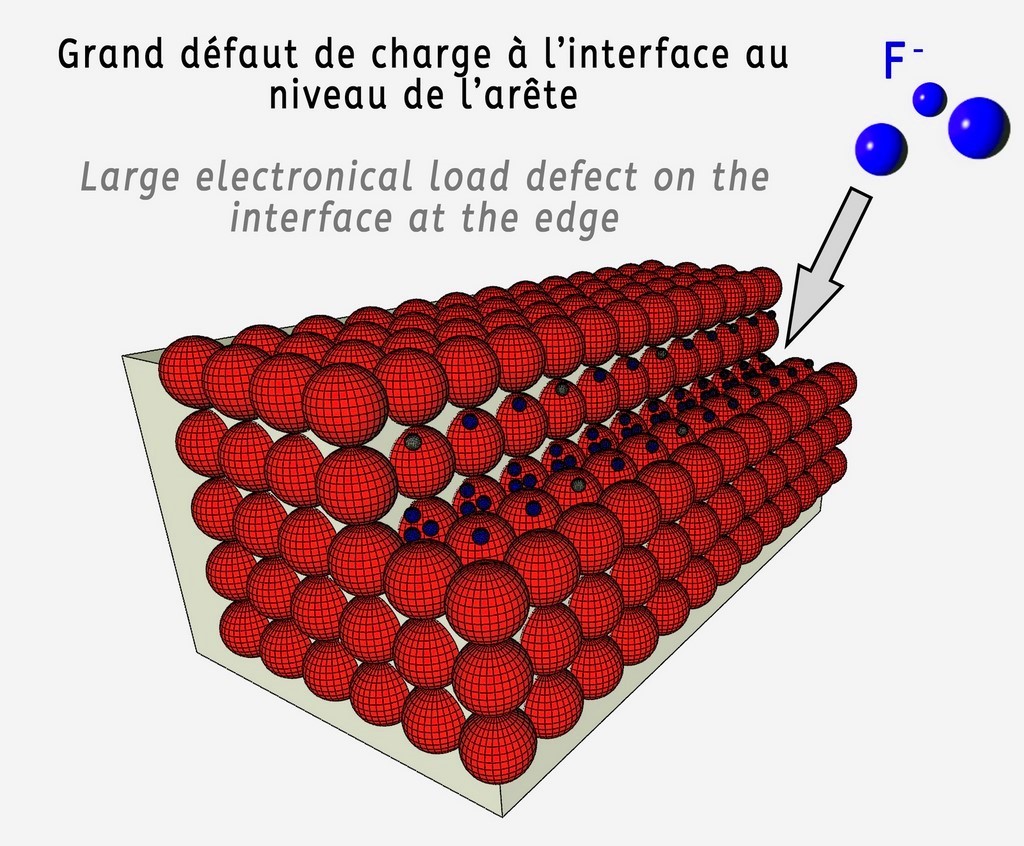
Sphère rouge = Atome de calcium (Ca 2+)
Sphère bleue = Atome de fluor (F -)
Sphère grise = Atome de fluor lacunaire permettant de rééquilibrer la charge électrique à l'échelle du cristal
Pourquoi le "défaut de Frenkel" est-il concentré toujours près du sommet du cube ?
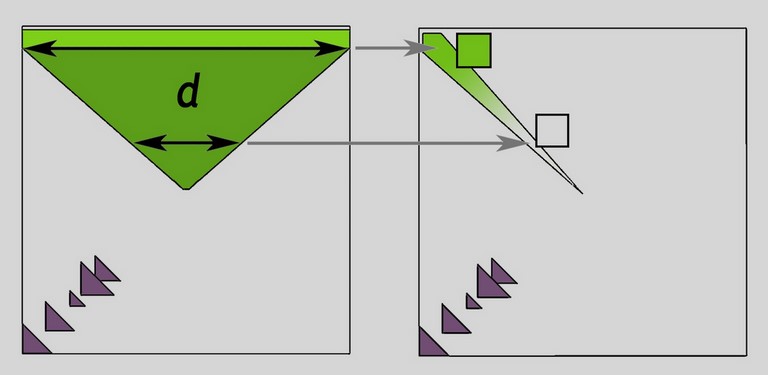
Relation entre couleur et épaisseur (d) de défauts traversée par la lumière